Бидний амьдарч буй ертөнц бол төсөөлөхийн аргагүй үзэсгэлэнтэй бөгөөд амьдралын замыг тодорхойлдог олон янзын үйл явцаар дүүрэн. Эдгээр бүх үйл явцыг танил шинжлэх ухаан - физик судалдаг. Энэ нь орчлон ертөнцийн гарал үүслийн талаар ядаж тодорхой ойлголттой болох боломжийг олгодог. Энэ нийтлэлд бид молекул кинетик онол, түүний тэгшитгэл, төрөл, томьёо гэх мэт ойлголтыг авч үзэх болно. Гэсэн хэдий ч эдгээр асуудлыг илүү гүнзгий судлахын өмнө та физикийн утга учир болон түүний судалдаг салбаруудыг өөртөө тодруулах хэрэгтэй.
Физик гэж юу вэ?

Үнэндээ энэ бол маш өргөн цар хүрээтэй шинжлэх ухаан бөгөөд магадгүй хүн төрөлхтний түүхэн дэх хамгийн суурь шинжлэх ухааны нэг юм. Жишээлбэл, ижил компьютерийн шинжлэх ухаан нь тооцооллын дизайн эсвэл хүүхэлдэйн кино бүтээх гэх мэт хүний үйл ажиллагааны бараг бүх салбартай холбоотой бол физик бол амьдрал өөрөө, түүний нарийн төвөгтэй үйл явц, урсгалын дүрслэл юм. Ойлголтыг аль болох хялбарчилж утгыг нь тайлахыг хичээцгээе.
ТэгэхээрТиймээс физик бол энерги, бодис, тэдгээрийн хоорондын холбоо, бидний өргөн уудам орчлон ертөнцөд болж буй олон үйл явцын тайлбарыг судалдаг шинжлэх ухаан юм. Бодисын бүтцийн молекул-кинетик онол бол физикийн онол, салбаруудын далайд өчүүхэн дусал төдий юм.
Энэ шинжлэх ухааны нарийн судалдаг эрчим хүчийг олон янзаар илэрхийлж болно. Жишээлбэл, гэрэл, хөдөлгөөн, таталцал, цацраг, цахилгаан болон бусад олон хэлбэрээр. Бид энэ өгүүллээр эдгээр хэлбэрийн бүтцийн молекул кинетик онолыг хөндөх болно.
Матери судлах нь бодисын атомын бүтцийн тухай ойлголтыг өгдөг. Дашрамд хэлэхэд, энэ нь молекул-кинетик онолоос үүдэлтэй. Материйн бүтцийн шинжлэх ухаан нь бидний оршин тогтнох утга учрыг, амьдрал болон Орчлон ертөнц өөрөө үүссэн шалтгааныг ойлгох, олох боломжийг олгодог. Бодисын молекул кинетик онолыг судлахыг хичээцгээе.
Нэгдүгээрт, нэр томьёо болон аливаа дүгнэлтийг бүрэн ойлгохын тулд зарим нэг танилцуулга хэрэгтэй.
Физикийн сэдэв
Молекул-кинетик онол гэж юу вэ гэсэн асуултад хариулахдаа физикийн хэсгүүдийн талаар ярихаас өөр аргагүй. Эдгээр нь тус бүр нь хүний амьдралын тодорхой хэсгийг нарийвчлан судлах, тайлбарлахтай холбоотой юм. Тэдгээрийг дараах байдлаар ангилдаг:
- Механик нь кинематик ба динамик гэсэн хоёр хэсэгт хуваагддаг.
- Статик.
- Термодинамик.
- Молекулын хэсэг.
- Электродинамик.
- Оптик.
- Квантын физик ба атомын цөм.
Молекулын талаар тусгайлан ярилцъяфизик, учир нь энэ нь молекул-кинетик онол дээр суурилдаг.
Термодинамик гэж юу вэ?
Ер нь молекулын хэсэг ба термодинамик нь физикийн нийт тооны макроскопийн бүрэлдэхүүн хэсгийг судалдаг физикийн нягт холбоотой салбарууд юм. Эдгээр шинжлэх ухаан нь бие махбодь ба бодисын дотоод байдлыг яг таг тодорхойлдог гэдгийг санах нь зүйтэй. Жишээлбэл, атомын түвшинд халаах, талсжих, уурших, конденсацлах үеийн төлөв байдал. Өөрөөр хэлбэл молекулын физик нь атом, молекул гэсэн асар олон тооны бөөмсөөс тогтдог системийн шинжлэх ухаан юм.
Эдгээр шинжлэх ухаан молекул кинетик онолын үндсэн заалтуудыг судалсан.
Бид долдугаар ангидаа ч гэсэн бичил болон макро ертөнц, систем гэсэн ойлголттой танилцсан. Эдгээр нэр томъёог санах ойд сэргээх нь илүүц байх болно.
Бичил ертөнц нь бидний нэрнээс нь харахад энгийн бөөмсөөс бүрддэг. Өөрөөр хэлбэл, энэ бол жижиг хэсгүүдийн ертөнц юм. Тэдгээрийн хэмжээг 10-18 м-ээс 10-4 м-ийн хооронд хэмждэг бөгөөд тэдгээрийн бодит төлөвийн хугацаа нь хязгааргүй болон аль алинд нь хүрч болно. пропорциональ бус жижиг интервалууд, жишээлбэл, 10-20 s.
Macroworld нь олон тооны энгийн тоосонцороос тогтсон тогтвортой хэлбэрийн бие, системийг авч үздэг. Ийм систем нь бидний хүний хэмжээтэй таарч байна.
Үүнээс гадна мега ертөнц гэж байдаг. Энэ нь асар том гаригууд, сансрын галактикууд болон цогцолборуудаас бүрддэг.
Үндсэнонол
Одоо бид бага зэрэг дүгнэж, физикийн үндсэн нэр томьёог санасан тул энэ нийтлэлийн үндсэн сэдэв рүү шууд орж болно.
Молекул-кинетик онол анх удаа XIX зуунд бий болж, томъёолсон. Түүний мөн чанар нь Роберт Хук, Исаак зэрэг нэрт эрдэмтдийн таамаглалаас цуглуулсан гурван үндсэн заалт дээр үндэслэн аливаа бодисын бүтцийг (хатуу ба шингэн биетээс илүү хийн бүтэц) нарийвчлан тодорхойлсонд оршино. Ньютон, Даниел Бернулли, Михаил Ломоносов болон бусад олон.
Молекул кинетик онолын үндсэн заалтууд дараах байдалтай байна:
- Үнэхээр бүх бодисууд (шингэн, хатуу, хийн хэлбэрээс үл хамааран) молекул, атом гэсэн жижиг хэсгүүдээс бүрдсэн нарийн төвөгтэй бүтэцтэй байдаг. Атомыг заримдаа "элементар молекул" гэж нэрлэдэг.
- Эдгээр бүх энгийн бөөмс үргэлж тасралтгүй, эмх замбараагүй хөдөлгөөнтэй байдаг. Бидний хүн нэг бүр энэ саналын шууд нотолгоог олж мэдсэн боловч үүнд нэг их ач холбогдол өгөөгүй байх. Жишээлбэл, тоосны тоосонцор эмх замбараагүй чиглэлд байнга хөдөлж байгааг нарны цацрагийн арын дэвсгэр дээр бид бүгд харсан. Энэ нь атомууд бие биедээ харилцан түлхэлт үүсгэж, бие биедээ кинетик энергийг байнга өгдөгтэй холбоотой юм. Энэ үзэгдлийг анх 1827 онд судалж, нээсэн хүний нэрээр "Брауны хөдөлгөөн" гэж нэрлэжээ.
- Бүх энгийн бөөмсүүд хоорондоо тасралтгүй харилцан үйлчлэлийн явцад байдаг.цахилгаан чулуулаг бүхий тодорхой хүч.
Хоёрдугаар байрлалыг тодорхойлсон өөр нэг жишээ нь хийн молекул кинетик онолд бас хамаатай байж болох нэг жишээ бол диффуз гэдгийг тэмдэглэх нь зүйтэй. Бид үүнийг өдөр тутмын амьдралд болон олон туршилт, хяналт шалгалтын явцад тулгардаг тул энэ талаар санаатай байх нь чухал.
Эхлээд дараах жишээнүүдийг авч үзье:
Эмч санамсаргүйгээр ширээн дээр байсан колбоноос архи асгав. Эсвэл та үнэртэй усны саваа унагаад шалан дээр тарсан байж магадгүй.
Яагаад энэ хоёр тохиолдолд архины үнэр, үнэртэй усны үнэр хоёулаа хэсэг хугацааны дараа зөвхөн эдгээр бодис асгарсан хэсэг биш өрөөг бүхэлд нь дүүргэх болов уу?
Хариулт нь энгийн: тархалт.
Диффузи - энэ юу вэ? Энэ яаж урсдаг вэ?

Энэ нь нэг бодисыг (ихэвчлэн хий) бүрдүүлдэг тоосонцор нөгөө бодисын молекул хоорондын хоосон зайд нэвтрэн орох үйл явц юм. Дээрх бидний жишээн дээр дараахь зүйл тохиолдсон: дулааны, өөрөөр хэлбэл тасралтгүй, салангид хөдөлгөөнөөс болж архи ба / эсвэл сүрчигний молекулууд агаарын молекулуудын хоорондын зайд унасан. Аажмаар агаарын атом ба молекулуудтай мөргөлдөх нөлөөн дор тэд өрөөний эргэн тойронд тархдаг. Дашрамд хэлэхэд, диффузийн эрч хүч, өөрөөр хэлбэл түүний урсгалын хурд нь тархалтад оролцдог бодисын нягтрал, түүнчлэн кинетик гэж нэрлэгддэг тэдгээрийн атом, молекулуудын хөдөлгөөний энергиээс хамаарна. Кинетик энерги их байх тусам эдгээр молекулуудын хурд, эрчим нь өндөр болно.
Хамгийн хурдан тархах процессыг хий дэх диффуз гэж нэрлэж болно. Энэ нь хий нь найрлагадаа нэг төрлийн биш байдагтай холбоотой бөгөөд энэ нь хий дэх молекул хоорондын хоосон зай нь ихээхэн хэмжээний орон зай эзэлдэг бөгөөд тэдгээрт гадны бодисын атом, молекулыг оруулах үйл явц илүү хялбар бөгөөд хурдан явагддаг..
Шингэнд энэ процесс арай удаан явагддаг. Нэг аяга цайнд шоо элсэн чихэр уусах нь шингэн дэх хатуу биет тархаж буйн жишээ юм.
Гэхдээ хамгийн урт хугацаа бол хатуу талст бүтэцтэй биед тархах явдал юм. Хатуу биетийн бүтэц нь нэгэн төрлийн бөгөөд хүчтэй болор тортой, эсэд нь хатуу бодисын атомууд чичирдэг тул яг ийм байна. Жишээлбэл, хэрэв хоёр металл баарны гадаргууг сайтар цэвэрлэж, дараа нь бие биентэйгээ харьцах юм бол хангалттай удаан хугацааны дараа бид нэг металлын хэсгүүдийг нөгөөд нь илрүүлэх боломжтой болно.
Бусад суурь хэсгүүдийн нэгэн адил физикийн үндсэн онол нь ангилал, төрөл, томьёо, тэгшитгэл гэх мэт тусдаа хэсгүүдэд хуваагддаг. Тиймээс бид молекул кинетик онолын үндсийг сурсан. Энэ нь та онолын блокуудыг тусад нь авч үзэх боломжтой гэсэн үг.
Хийн молекул-кинетик онол
Хийн онолын заалтуудыг ойлгох хэрэгтэй. Өмнө дурьдсанчлан бид хийн даралт, температур зэрэг макроскоп шинж чанарыг авч үзэх болно. Энэ болхийн молекул-кинетик онолын тэгшитгэлийг гаргахын тулд дараа нь хэрэгтэй болно. Гэхдээ математик - дараа нь, одоо онол, үүний дагуу физикийн талаар ярилцъя.
Эрдэмтэд хийн кинетик загварыг ойлгоход үйлчилдэг хийн молекулын онолын таван заалтыг боловсруулсан. Тэд ингэж сонсогдож байна:
- Бүх хий нь тодорхой хэмжээтэй биш, харин тодорхой масстай энгийн хэсгүүдээс тогтдог. Өөрөөр хэлбэл, эдгээр хэсгүүдийн хэмжээ нь тэдгээрийн хоорондох урттай харьцуулахад хамгийн бага байна.
- Хийн атом ба молекулууд бараг ямар ч боломжит энергигүй байдаг тул хуулийн дагуу бүх энерги нь кинетиктэй тэнцүү байдаг.
- Бид өмнө нь энэ байрлалтай танилцсан - Брауны хөдөлгөөн. Өөрөөр хэлбэл, хийн хэсгүүд үргэлж тасралтгүй, эмх замбараагүй хөдөлгөөнд байдаг.
- Хурд ба энергийн мэдээ дагалддаг хийн хэсгүүдийн харилцан мөргөлдөөн бүр бүрэн уян хатан байдаг. Энэ нь мөргөлдөх үед тэдний кинетик энерги нь эрчим хүчний алдагдал эсвэл огцом үсрэлт байхгүй гэсэн үг юм.
- Хэвийн нөхцөл ба тогтмол температурт бараг бүх хийн бөөмийн хөдөлгөөний дундаж энерги ижил байна.
Бид хийн молекул-кинетик онолын ийм төрлийн тэгшитгэлээр тав дахь байрлалыг дахин бичиж болно:
E=1/2mv^2=3/2kT, энд k нь Больцманы тогтмол; T - Келвин дэх температур.
Энэ тэгшитгэл нь хийн энгийн бөөмсийн хурд ба тэдгээрийн үнэмлэхүй температурын хоорондын хамаарлыг ойлгох боломжийг олгодог. Үүний дагуу тэдний үнэмлэхүй өндөр байх тусамтемператур, хурд, кинетик энерги төдий чинээ их болно.
Хийн даралт
Хийн даралт зэрэг шинж чанарын ийм макроскоп бүрэлдэхүүн хэсгүүдийг кинетик онолыг ашиглан тайлбарлаж болно. Үүнийг хийхийн тулд дараах жишээг төсөөлье.
Ямар нэг хийн молекулыг хайрцагт байгаа гэж бодъё, урт нь L. Дээр дурдсан хийн онолын заалтуудыг ашиглаж, молекулын бөмбөрцөг зөвхөн х-ийн дагуу хөдөлдөг болохыг харгалзан үзье. -тэнхлэг. Тиймээс бид хөлөг онгоцны аль нэг хананд (хайрцаг) уян харимхай мөргөлдөх үйл явцыг ажиглах боломжтой болно.
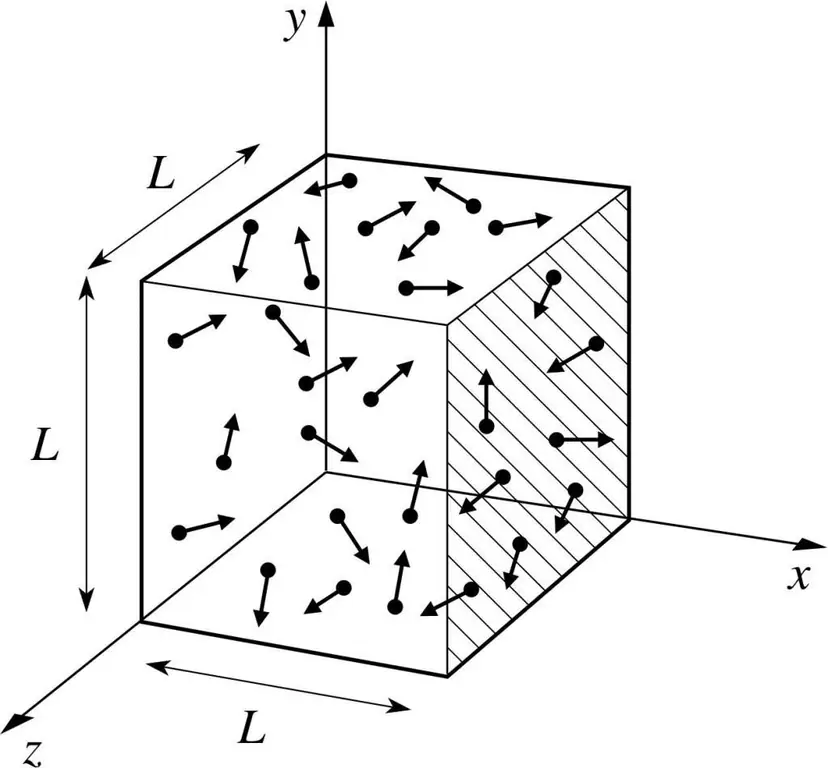
Бидний мэдэж байгаагаар үргэлжилсэн мөргөлдөөний импульс нь дараах томъёогоор тодорхойлогддог: p=mv, гэхдээ энэ тохиолдолд энэ томъёо нь проекцын хэлбэрийг авна: p=mv(x).
Бид зөвхөн x тэнхлэгийн хэмжээсийг, өөрөөр хэлбэл х тэнхлэгийг авч үзсэн тул импульсийн нийт өөрчлөлтийг mv(x) - m(-v() томъёогоор илэрхийлнэ. x))=2mv(x).
Дараа нь Ньютоны 2-р хуулийг ашиглан бидний объектын үзүүлэх хүчийг авч үзье: F=ma=P/t.
Эдгээр томъёоноос бид хийн талын даралтыг илэрхийлнэ: P=F/a;
Одоо үүссэн томъёонд хүчний илэрхийлэлийг орлуулж дараахийг олж авна уу: P=mv(x)^2/L^3.
Үүний дараа хийн молекулуудын N-р тооны хувьд бидний эцсийн даралтын томъёог бичиж болно. Өөрөөр хэлбэл, иймэрхүү харагдах болно:
P=Nmv(x)^2/V, энд v нь хурд, V нь хэмжээ.
Одоо хийн даралтын талаархи хэд хэдэн үндсэн заалтуудыг онцлон үзэхийг оролдъё:
- Үүгээр дамжуулан илэрдэгмолекулууд нь түүний байрлах объектын хананы молекулуудтай мөргөлдөх.
- Даралтын хэмжээ нь молекулуудын савны хананд үзүүлэх хүч, хурдтай шууд пропорциональ байна.
Онолын талаархи зарим товч дүгнэлт
Молекул кинетик онолын үндсэн тэгшитгэлийг авч үзэхээсээ өмнө дээрх онол, онолын товч дүгнэлтийг танд санал болгож байна:
- Атом ба молекулуудын хөдөлгөөний дундаж энергийн хэмжүүр нь үнэмлэхүй температур юм.
- Хоёр өөр хий ижил температурт байх үед тэдгээрийн молекулууд ижил дундаж кинетик энергитэй байна.
- Хийн бөөмсийн энерги нь дундаж квадрат хурдтай шууд пропорциональ: E=1/2mv^2.
- Хийн молекулууд дунджаар кинетик энерги болон дундаж хурдтай байдаг ч бие даасан хэсгүүд өөр өөр хурдтайгаар хөдөлдөг: зарим нь хурдан, зарим нь удаан.
- Температур өндөр байх тусам молекулуудын хурд өндөр болно.
- Бид хийн температурыг хэдэн удаа нэмэгдүүлэхэд (жишээлбэл, хоёр дахин) түүний бөөмсийн хөдөлгөөний энерги хэд дахин нэмэгддэг (тус тус бүр хоёр дахин нэмэгддэг).
Үндсэн тэгшитгэл ба томьёо

Молекул кинетик онолын үндсэн тэгшитгэл нь бичил ертөнцийн хэмжигдэхүүн ба үүний дагуу макроскоп, өөрөөр хэлбэл хэмжигдэх хэмжигдэхүүний хоорондын хамаарлыг тогтоох боломжийг олгодог.
Молекулын онолын авч үзэж болох хамгийн энгийн загваруудын нэг бол хамгийн тохиромжтой хийн загвар юм.
Та ингэж хэлж болноЭнэ бол идеал хийн молекул кинетик онолоор судлагдсан нэг төрлийн төсөөллийн загвар бөгөөд үүнд:
- Хамгийн энгийн хийн хэсгүүд нь зөвхөн нэг тохиолдолд бие биетэйгээ болон аливаа савны хананы молекулуудтай харилцан үйлчилдэг төгс уян бөмбөлөг гэж тооцогддог - туйлын уян харимхай мөргөлдөөн;
- хийн доторх таталцлын хүч байхгүй, эсвэл тэдгээрийг үл тоомсорлож болно;
- хийн дотоод бүтцийн элементүүдийг материаллаг цэг болгон авч болно, өөрөөр хэлбэл тэдгээрийн эзэлхүүнийг бас үл тоомсорлож болно.
Ийм загварыг авч үзэн Герман гаралтай физикч Рудольф Клаузиус бичил болон макроскопийн үзүүлэлтүүдийн хамаарлаар хийн даралтын томьёог бичжээ. Энэ нь иймэрхүү харагдаж байна:
p=1/3m(0)nv^2.
Хожим нь энэ томьёог идеал хийн молекул-кинетик онолын үндсэн тэгшитгэл гэж нэрлэх болно. Үүнийг хэд хэдэн хэлбэрээр танилцуулж болно. Одоо бидний үүрэг бол молекулын физик, молекул кинетик онол, улмаар тэдгээрийн бүрэн тэгшитгэл, төрлүүд зэрэг хэсгүүдийг харуулах явдал юм. Тиймээс үндсэн томъёоны бусад хувилбаруудыг авч үзэх нь зүйтэй юм.
Хийн молекулуудын хөдөлгөөнийг тодорхойлдог дундаж энергийг E=m(0)v^2/2 томъёогоор олж болохыг бид мэднэ.
Энэ тохиолдолд бид анхны даралтын томьёо дахь m(0)v^2 илэрхийллийг дундаж кинетик энергиэр сольж болно. Үүний үр дүнд бид хийн молекул кинетик онолын үндсэн тэгшитгэлийг дараах хэлбэрээр бүтээх боломжтой болно: p=2/3nE.
Түүгээр ч барахгүй m(0)n илэрхийллийг хоёр хэсгийн үржвэр хэлбэрээр бичиж болно гэдгийг бид бүгд мэднэ:
m/NN/V=m/V=ρ.
Эдгээр заль мэх хийсний дараа бид идеал хийн молекул-кинетик онолын тэгшитгэлийн томъёогоо гурав дахь, өөр хэлбэрээр дахин бичиж болно:
p=1/3ρv^2.
За, магадгүй энэ сэдвийн талаар мэдэх ёстой зүйл л энэ байх. Зөвхөн товч (мөн тийм биш) дүгнэлт хэлбэрээр олж авсан мэдлэгээ системчлэх л үлддэг.
"Молекул-кинетик онол" сэдвээрх бүх ерөнхий дүгнэлт, томьёо
Тиймээс эхэлцгээе.
Эхний:
Физик бол бодис ба энергийн шинж чанар, тэдгээрийн бүтэц, органик бус байгалийн зүй тогтлыг судалдаг байгалийн ухааны хичээлд багтсан суурь шинжлэх ухаан юм.
Энэ нь дараах хэсгүүдийг агуулна:
- механик (кинематик ба динамик);
- статик;
- термодинамик;
- электродинамик;
- молекулын хэсэг;
- оптик;
- квантын физик ба атомын цөм.
Хоёр дахь:
Бөөмийн физик ба термодинамик нь физик системийн нийт тооны макроскопийн бүрэлдэхүүн хэсэг буюу асар олон тооны энгийн бөөмсөөс бүрдэх системийг судалдаг нягт холбоотой салбар юм.
Тэдгээр нь молекул кинетик онол дээр суурилдаг.
Гурав:
Хамгийн гол нь энэ. Молекул кинетик онол нь бодисын бүтцийг (хатуу бодисоос илүү ихэвчлэн хийн бүтцийг) нарийвчлан тодорхойлдог.ба шингэн биетүүд), нэрт эрдэмтдийн таамаглалаас цуглуулсан гурван үндсэн таамаглал дээр үндэслэсэн. Тэдний дунд: Роберт Хук, Исаак Ньютон, Даниел Бернулли, Михаил Ломоносов болон бусад олон.
Дөрөвдүгээрт:
Молекул кинетик онолын гурван үндсэн зарчим:
- Бүх бодис (шингэн, хатуу, хийн хэлбэрээс үл хамааран) молекул, атом гэсэн жижиг хэсгүүдээс бүрдсэн цогц бүтэцтэй.
- Эдгээр бүх энгийн бөөмс тасралтгүй эмх замбараагүй хөдөлгөөнд байдаг. Жишээ: Брауны хөдөлгөөн ба тархалт.
- Бүх молекулууд ямар ч нөхцөлд бие биетэйгээ цахилгаан чулуулаг бүхий тодорхой хүчээр харилцан үйлчилдэг.
Молекул кинетик онолын эдгээр заалт бүр нь материйн бүтцийг судлах баттай суурь юм.
Тавдугаарт:
Хийн загварын молекулын онолын хэд хэдэн гол санаа:
- Бүх хий нь тодорхой хэмжээтэй биш, харин тодорхой масстай энгийн хэсгүүдээс тогтдог. Өөрөөр хэлбэл, эдгээр хэсгүүдийн эзэлхүүн нь тэдгээрийн хоорондох зайтай харьцуулахад хамгийн бага байна.
- Хийн атом ба молекулууд бараг ямар ч боломжит энергигүй тул нийт энерги нь кинетиктэй тэнцүү байна.
- Бид өмнө нь энэ байрлалтай танилцсан - Брауны хөдөлгөөн. Өөрөөр хэлбэл, хийн хэсгүүд үргэлж тасралтгүй, санамсаргүй хөдөлгөөнд байдаг.
- Хурд, энергийн мэдээ дагалддаг хийн атом ба молекулуудын харилцан мөргөлдөөн бүр бүрэн уян хатан байдаг. Энэ болмөргөлдөх үед тэдний кинетик энерги нь эрчим хүчний алдагдал эсвэл огцом үсрэлт байхгүй гэсэн үг юм.
- Хэвийн нөхцөл ба тогтмол температурт бараг бүх хийн дундаж кинетик энерги ижил байна.
Зургаа дахь:
Хийн тухай онолын дүгнэлт:
- Үнэмлэхүй температур нь түүний атом ба молекулуудын дундаж кинетик энергийн хэмжүүр юм.
- Хоёр өөр хий ижил температурт байх үед тэдгээрийн молекулууд ижил дундаж кинетик энергитэй байна.
- Хийн бөөмсийн дундаж кинетик энерги нь дундаж квадрат хурдтай шууд пропорциональ байна: E=1/2mv^2.
- Хийн молекулууд дунджаар кинетик энерги болон дундаж хурдтай байдаг ч бие даасан хэсгүүд өөр өөр хурдтайгаар хөдөлдөг: зарим нь хурдан, зарим нь удаан.
- Температур өндөр байх тусам молекулуудын хурд өндөр болно.
- Бид хийн температурыг хэдэн удаа нэмэгдүүлэхэд (жишээлбэл, хоёр дахин) түүний бөөмсийн дундаж кинетик энерги мөн олон дахин нэмэгддэг (тус тус хоёр дахин нэмэгддэг).
- Байршсан савны ханан дахь хийн даралт ба эдгээр хананд молекулуудын нөлөөллийн эрчмийн хоорондын хамаарал нь шууд пропорциональ: нөлөөлөл их байх тусам даралт ихсэх ба эсрэгээр.
Долоо дахь:
Хамгийн тохиромжтой хийн загвар нь дараах нөхцлийг хангасан загвар юм:
- Хийн молекулууд нь төгс уян бөмбөлөг байж чаддаг ба тэдгээрт тооцогддог.
- Эдгээр бөмбөлгүүд бие биетэйгээ болон аль ч бөмбөгний ханатай харьцаж болнохөлөг онгоц зөвхөн нэг тохиолдолд - туйлын уян хатан мөргөлдөөн.
- Хийн атом ба молекулуудын харилцан түлхэцийг дүрсэлсэн хүчнүүд байхгүй эсвэл үнэндээ үл тоомсорлож болно.
- Атом ба молекулуудыг материаллаг цэг гэж үздэг, өөрөөр хэлбэл тэдгээрийн эзэлхүүнийг ч үл тоомсорлож болно.
Найм дахь:
Бүх үндсэн тэгшитгэлүүдийг өгч, "Молекул-кинетик онол" сэдвээр томьёог үзүүлье:
p=1/3m(0)nv^2 - Германы физикч Рудольф Клаусиусын гаргасан идеал хийн загварын үндсэн тэгшитгэл.
p=2/3nE - идеал хийн молекул-кинетик онолын үндсэн тэгшитгэл. Молекулуудын дундаж кинетик энергиэс үүсэлтэй.
р=1/3ρv^2 - ижил тэгшитгэл, гэхдээ хамгийн тохиромжтой хийн молекулуудын нягт ба язгуур дундаж квадрат хурдаар авч үзсэн.
m(0)=M/N(a) - Авогадро тоогоор дамжуулан нэг молекулын массыг олох томьёо.
v^2=(v(1)+v(2)+v(3)+…)/N - молекулын дундаж квадрат хурдыг олох томъёо, энд v(1), v(2), v (3) гэх мэт - эхний молекулын хурд, хоёр дахь, гурав дахь гэх мэт n-р молекул хүртэлх хурд.
n=N/V - молекулуудын концентрацийг олох томьёо, энд N нь өгөгдсөн V эзлэхүүн хүртэлх хийн эзэлхүүн дэх молекулуудын тоо юм.
E=mv^2/2=3/2kT - молекулын дундаж кинетик энергийг олох томьёо, энд v^2 нь молекулуудын язгуур дундаж квадрат хурд, k нь тогтмол Австрийн нэрээр нэрлэгдсэн утга нь Людвиг Больцманы физик, T нь хийн температур юм.
p=nkT - концентрацийн хувьд даралтын томъёо, тогтмолБольцман ба үнэмлэхүй температур Т. Үүнээс Оросын эрдэмтэн Менделеев, Францын физикч-инженер Клайперон нарын нээсэн өөр нэг үндсэн томъёо гарч ирнэ:
pV=m/MRT, энд R=kN(a) нь хийн бүх нийтийн тогтмол юм.
Одоо изобар, изохор, изотерм болон адиабат гэсэн янз бүрийн изо-процессуудын тогтмолуудыг харуулъя.
pV/T=const - хийн масс болон найрлага тогтмол байх үед гүйцэтгэнэ.
рV=const - хэрэв температур мөн тогтмол байвал.
V/T=const - хийн даралт тогтмол байвал.
p/T=const - хэрэв дууны хэмжээ тогтмол байвал.
Магадгүй энэ нь танд энэ сэдвээр мэдэх хэрэгтэй.
Өнөөдөр бид онолын физик, түүний олон хэсэг, блок зэрэг шинжлэх ухааны салбар руу орлоо. Молекулын физик ба термодинамикийн суурь, тухайлбал молекул-кинетик онол гэх мэт физикийн салбарыг илүү нарийвчлан авч үзсэн бөгөөд энэ нь анхан шатны судалгаанд ямар ч хүндрэл учруулдаггүй боловч үнэн хэрэгтээ олон алдаатай байдаг.. Энэ нь бидний нарийвчлан судалж үзсэн хамгийн тохиромжтой хийн загварын талаарх бидний ойлголтыг өргөжүүлдэг. Нэмж дурдахад бид молекулын онолын үндсэн тэгшитгэлүүдтэй тэдгээрийн янз бүрийн хувилбаруудтай танилцаж, мөн энэ сэдвээр тодорхой үл мэдэгдэх хэмжигдэхүүнийг олоход шаардлагатай бүх томъёог авч үзсэнийг тэмдэглэх нь зүйтэй. Энэ нь ялангуяа бичихэд бэлтгэхэд хэрэг болно. аливаа шалгалт, шалгалт, шалгалт эсвэл физикийн ерөнхий үзэл бодол, мэдлэгийг өргөжүүлэх.
Энэ нийтлэл танд хэрэг болсон гэж найдаж байгаа бөгөөд та эндээс зөвхөн хамгийн хэрэгцээтэй мэдээллийг гаргаж авч, молекулын кинетик онолын үндсэн заалтууд зэрэг термодинамикийн тулгуур багана дахь мэдлэгээ бэхжүүлсэн болно.






