Кондуктометрийн шинжилгээний арга нь химийн урвалын явцыг хянахын тулд электролитийн дамжуулалтыг хэмжих арга юм. Энэ шинжлэх ухаан нь аналитик химийн салбарт өргөн хэрэглэгддэг бөгөөд титрлэлт нь үйл ажиллагааны стандарт арга юм. Кондуктометр гэж юу вэ? Аналитик химийн нийтлэг практикт энэ нэр томъёог титрлэхийн синоним болгон ашигладаг бол титрлээгүй хэрэглээг тодорхойлоход ашигладаг. Энэхүү шинжилгээний аргыг ашиглах нь ямар давуу талтай вэ? Энэ нь ихэвчлэн уусмалын ерөнхий дамжуулалтыг тодорхойлох эсвэл ионуудтай титрлэлтийн төгсгөлийн цэгийг шинжлэхэд ашиглагддаг.
Түүх
Дамжуулалтын хэмжилтүүд аль 18-р зуунд Андреас Баумгартнер Бад Гаштейны давс, рашаан усыг ажигласнаар эхэлсэн. Австри цахилгаан дамжуулдаг. Тиймээс өнөөдөр ус цэвэршүүлэх системийн үр нөлөөг шалгахад ихэвчлэн ашигладаг усны цэвэршилтийг тодорхойлох энэ аргыг ашиглах нь 1776 оноос эхэлсэн. Ийнхүү кондуктометрийн шинжилгээний аргын түүх эхэлсэн.
Фридрих Колрауш 1860-аад онд ус, хүчил болон бусад уусмалд хувьсах гүйдэл хэрэглэж байхдаа энэ шинжлэх ухааны хөгжлийг үргэлжлүүлсэн. Энэ үед хүхрийн хүчил ба хромын сульфатын нэгдлүүдийн харилцан үйлчлэлийг судалж байсан Уиллис Уитни анхны кондуктометрийн төгсгөлийн цэгийг олжээ. Эдгээр олдворууд нь потенциометрийн титрлэхэд хүрч, 1883 онд Роберт Беренд хлорид ба бромидын HgNO3-ийн титрлэлтийн эзэлхүүний шинжилгээний анхны хэрэгсэл болжээ. Тиймээс орчин үеийн кондуктометрийн шинжилгээний арга нь Беренд дээр суурилдаг.
Энэхүү бүтээн байгуулалт нь давсны уусах чадвар, устөрөгчийн ионы концентрацийг турших, түүнчлэн хүчил-суурь болон исэлдэлтийн титрлэлтийг шалгах боломжтой болгосон. 1909 онд эхэлсэн шилэн электродыг хөгжүүлснээр кондуктометрийн шинжилгээний аргыг сайжруулсан.
Титрлэлт
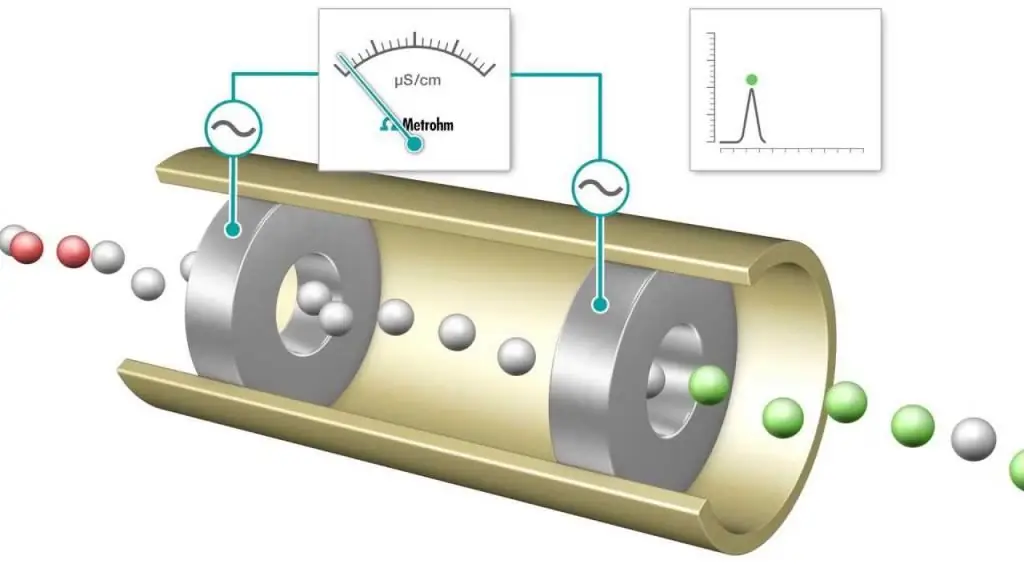
Кондуктометрийн титрлэлт нь урвалын хольцын электролитийн дамжуулалтыг нэг урвалж нэмж тасралтгүй хянах хэмжилт юм. Эквивалент цэг нь цахилгаан дамжуулах чанар гэнэт өөрчлөгдөх цэг юм. Дамжуулах чадвар мэдэгдэхүйц нэмэгдэх эсвэл буурах нь хамгийн өндөр дамжуулагч хоёр ион болох устөрөгч ба гидроксидын ионуудын концентраци өөрчлөгдсөнтэй холбоотой юм. Энэ аргаУламжлалт индикатороор ашиглах боломжгүй нэгэн төрлийн суспензийг (жишээ нь, модны нухаш) титрлэхэд ашиглаж болно.
Хүчил-суурь ба исэлдэлтийн титрлэлтийг ихэвчлэн хийдэг бөгөөд үүнд метил оранж, хүчил-суурь титрлэхэд фенолфталеин, иодометрийн төрлийн исэлдэлтийн процесст цардуулын уусмал зэрэг эцсийн цэгийг тодорхойлох нийтлэг үзүүлэлтүүдийг ашигладаг. Гэсэн хэдий ч цахилгаан дамжуулах чанарын хэмжилтийг эцсийн цэгийг тодорхойлох хэрэгсэл болгон ашиглаж болно, жишээлбэл, NaOH хүчтэй суурьтай HCl-ийн уусмалыг ажиглах үед.
Протон саармагжуулах
Титрлэх явцад протонуудыг саармагжуулж NaOH үүсгэн ус үүсгэдэг. Нэмсэн NaOH-ийн хэмжээ бүрт тэнцүү тооны устөрөгчийн ионыг арилгана. Үнэн хэрэгтээ хөдөлгөөнт H+ катион нь хөдөлгөөн багатай Na+ ионоор солигдож, титрлэгдсэн уусмалын дамжуулах чанар, түүнчлэн хэмжсэн эсийн дамжуулалт буурдаг. Энэ нь натрийн хлоридын NaCl уусмал авах эквивалент цэгт хүрэх хүртэл үргэлжилнэ. Хэрэв илүү их суурь нэмбэл илүү их Na+ болон OH- ионууд нэмэгдэх ба саармагжуулах урвал нь H+-г мэдэгдэхүйц хэмжээгээр арилгахаа больсон тул нэмэгдэнэ.

Тиймээс хүчтэй хүчлийг хүчтэй суурьтай титрлэхэд цахилгаан дамжуулах чанар эквивалент цэг дээр хамгийн бага байна. Энэ хамгийн багатитрлэлтийн төгсгөлийн цэгийг тодорхойлохын тулд индикатор будгийн оронд хэрэглэж болно. Титрлэлтийн муруй нь нэмэлт NaOH уусмалын эзэлхүүнээс хамаарсан дамжуулалт эсвэл дамжуулалтын хэмжсэн утгын график юм. Титрлэлтийн муруйг графикаар эквивалент цэгийг тодорхойлоход ашиглаж болно. Кондуктометрийн шинжилгээний арга (мөн түүний хэрэглээ) нь орчин үеийн химийн шинжлэх ухаанд маш их хамааралтай.
Харилцаа
Сул хүчил-сул суурийн хоорондох урвалын хувьд цөөн тооны H+ ион ашигладаг тул цахилгаан дамжуулах чанар эхлээд бага зэрэг буурдаг. Дараа нь цахилгаан дамжуулах чанар нь давсны катион ба анионы хувь нэмэрээс шалтгаалан эквивалент цэгийн эзэлхүүн хүртэл бага зэрэг нэмэгддэг (хүчтэй хүчиллэг суурийн хувьд энэ хувь нэмэр маш бага бөгөөд тэнд тооцогдохгүй.) Эквивалент цэгт хүрсний дараа., OH ионууд илүүдэлтэй тул цахилгаан дамжуулах чанар хурдан нэмэгддэг.
Дамжуулах чадвар илрүүлэгч (кондуктометрийн шинжилгээний арга) нь усан уусмал дахь электролитийн концентрацийг хэмжихэд мөн ашиглагддаг. Уусмалын дамжуулалтыг бий болгодог аналитийн молийн концентрацийг уусмалын хэмжсэн цахилгаан эсэргүүцлээс авч болно.
Кондуктометрийн шинжилгээний арга: зарчим ба томьёо
(2.4.13) C=Constcell1Λm1Res, Constcell нь хэмжих нүднээс хамаарах тогтмол утга, Res нь төхөөрөмжийн хэмжсэн цахилгаан эсэргүүцэл (Омын хуулийн дагуу Res=I / V, тогтмол хэмжигдэхүүнтэй) V хүчдэлийн хэмжилт I эрчим нь Res) тооцоолох боломжийг олгодог бөгөөд Λm нь тэнцүү байнаионы хэсгүүдийн дамжуулалт. Хэдийгээр практик зорилгоор Λm-ийг тогтмол гэж үзэж болох ч Колраушийн хуулийн дагуу концентрацаас хамаарна:
(2.4.14)=Хт Λm0-ΘC, энд Θ нь тогтмол, Λm0 нь ион бүрийн хязгаарлагдмал молийн дамжуулалтын шинж чанар юм. Моляр дамжуулалт нь эргээд температураас хамаарна.
Scrit
Хэмжилтийн шинжилгээний кондуктометрийн аргыг хөгжүүлснээр эрдэмтдийг шинэ нээлтүүдэд хүргэсэн. Эрдэмтэд CI ионуудын эх үүсвэр болох алкил хлоридын гидролизийг ашиглан Ag+ ионоос илүү хэмжээтэй нэгэн төрлийн AgCl хур тунадасны системд кондуктометрийн тусламжтайгаар нэн чухал хэт ханасан харьцаа болох Скритийг тодорхойлсон." Тэд Scrit=1.51, 1.73 ба 1.85-ийг 15, 25, 35°C-т тус тус олсон бөгөөд тэдгээрийн тодорхойлолтоор S=([Ag+][Cl-] / Ksp) 1/2 байна. Хэрэв хэт ханалтын хүчин зүйлийн энэхүү тодорхойлолтыг манайх руу хөрвүүлбэл (S=[Ag+][Cl-] / Ksp) үр дүн нь тус тус 2.28, 2.99, 3.42 байгаа нь энэхүү судалгааны үр дүнтэй нэлээд сайн тохирч байна. Гэсэн хэдий ч, Скритын температурын хамаарал нь энэ судалгаанд дурдсанаас эсрэг байна. Хэдийгээр энэ зөрчилдөөний шалтгаан тодорхойгүй байгаа ч температур нэмэгдэхийн хэрээр скритийн бууралт нь нэлээд үндэслэлтэй байж болох юм, учир нь бөөмийн хурд нь ΔGm/ кТ-ийн бага зэрэг өөрчлөлтөөр эрс өөрчлөгддөг тул T-тэй пропорциональ ΔGm/ kT байна. − 3 (lnSm) 2 (1.4.12) томъёоны дагуу өгөгдсөн систем дэх температурын өөрчлөлтөд бараг тогтмол байна гэж үзнэ. Дашрамд хэлэхэд, S-ийн тодорхойлолт нь [Ag +] [Cl -] / Ksp байх ёстой, учир нь хэт ханасан харьцаа нь[AgCl] мономерын концентрацийг эхлээд S=[AgCl] / [AgCl] (∞)=[Ag +] [Cl -] / Ksp гэж өгөгдсөн.
Танака, Ивасаки
Кондуктометрийн шинжилгээний аргын түүхийг Японы алдарт хоёр эрдэмтэн үргэлжлүүлсэн. Танака, Ивасаки нар AgCl ба AgBr бөөмсийн бөөмжих процессыг олон сувгийн спектрофотометртэй хослуулан зогссон урсгалын аргыг ашиглан судалсан нь msec дарааллаар хурдан процессыг судлахад тустай юм. Тэд 10-4 моль дм-3 хэмжээтэй AgC104-ийн уусмалыг KX (X=)-тэй холиход хэт ягаан туяаг шингээх нарийн зурвас бүхий AgXm (m-1) мөнгөн галидын зарим өвөрмөц цогцолбор нэн даруй үүссэн болохыг тогтоожээ. Cl эсвэл Br) 10-2-оос 10-1 моль дм-3 хэмжээтэй уусмал, дараа нь 10 мс орчим хурдан задарч, хэт ягаан туяаг өргөн шингээх чадвартай завсрын бүтээгдэхүүн үүсгэдэг, спектрийн өөрчлөлт нь хамаагүй удаан байдаг. завсрын бүтээгдэхүүний. Тэд завсрын бүтээгдэхүүнийг n молекулаас бүрдэх монодисперс цөм (AgX) n гэж тайлбарлаж, C прекурсор AgXm (m-1) - (n=7)-ийн янз бүрийн анхны концентрацийн хувьд t=0 үед -dC/dt α Cn харагдах харьцаанаас n-ийг тодорхойлсон. -10 AgCl, n=3-4 AgBr).

Гэсэн хэдий ч AgXm (m − 1) прекурсор нь стационар бусаар задардаг тул энэ процесст хагас стационар бөөмжилтийн онол хамаарахгүй тул үүссэн n-ийн утга нь nчухал цөмийн үнэ цэнэ. Хэрэв завсрын бүтээгдэхүүн нь монодисперс цөм агуулсан бол,мономерийн цогцолбороос үүссэн -dC/dt α C харьцааг хадгалахгүй байж болно. Хэрэв бид n-mer-ээс бага кластерууд тэнцвэрт байдалд байна гэж үзэхгүй бол ki − 1, ici − 1c1=ki, i − 1ci, хоорондоо дараалсан урвалд c1 → c2 → c3 →… → cn − 1 → cn., ба зөвхөн сүүлчийн алхам cn − 1 → cn эргэлт буцалтгүй; өөрөөр хэлбэл c1⇌c2⇌c3⇌… ⇌cn − 1 → cn.
Үүнээс гадна 2-оос n-1 хүртэлх кластеруудын концентрацийг үл тоомсорлох тэнцвэрийн концентрацитай гэж үзэх нь зүйтэй. Гэсэн хэдий ч эдгээр таамаглалыг зөвтгөх үндэслэл байхгүй бололтой. Нөгөөтэйгүүр, бид хурдацтай үйл явцын төгсгөлд эгзэгтэй цөмийн радиус болон хэт ханалтын коэффициент S-ийг AgCl19 кубын хувьд γ=101 mJ m − 2, AgBr 20 кубын хувьд γ=109 mJ m − 2 ашиглан тооцоолохыг оролдсон. n, AgCl19-ийн хувьд 7-10, AgBr20-ийн хувьд 3-4-ийн утгууд нь монодисперсийн цөмийн хэмжээтэй тэнцүү байна, n. Кондуктометрийн шинжилгээний арга нь зүгээр л батлахаас эхлээд биширч байх хүртэл янз бүрээр дүгнэж, химийн шинжлэх ухааныг шинээр төрүүлэв.
Үүний үр дүнд эрдэмтэд дараах томьёог нээсэн: n=9-тэй AgCl-ийн хувьд r=0.451 нм ба S=105; n=4-тэй AgBr-ийн хувьд r=0.358 нм ба S=1230. Тэдний систем нь 25 ° C-д 1.7-2.0 орчим AgCl-ийн чухал хэт ханалтыг авсан Дэвис, Жонс нарын системтэй харьцуулах боломжтой. AgNO3 ба KCl-ийн шингэрүүлсэн усан уусмалын ижил эзэлхүүнтэй шууд холих кондуктометрийг ашиглах нь хэт өндөр S утгууд нь бодит хэт ханалтын хүчин зүйлийг тусгахгүй байж болно.завсрын цөмтэй тэнцвэрт байдалд байна.
Хэт ягаан туяа шингээх
Хэт ягаан туяаг өргөн шингээх чадвартай завсрын бүтээгдэхүүнийг суурин бус дараалсан урвалаар үүсгэгдсэн өргөн хэмжээтэй тархалттай дундаж цөмөөс хамаагүй том хэмжээтэй гэж үзэх нь илүү үндэслэлтэй юм шиг санагддаг. Завсрын цөмүүдийн дараагийн удаашралтай өөрчлөлт нь Оствальд дахь боловсорч гүйцсэнтэй холбоотой бололтой.

Дээрх контекстэд Америкийн химич Нилсен мөн n=dlogJ ашиглан булингарт байдлын хэмжилтээс барийн сульфатын хэсгүүдийн бөөмжилтийн хувьд ижил төстэй n12 ба 103-аас их S-ийг гаргаж авсан. / dlogC нь Бехер-Дерингтэй төстэй онолын томъёонд. (1.3.37), гэхдээ n -ийн оронд (n+ 1) өгч байна. Энэ туршилтанд барийн ион ба сульфатын ионуудын уусмалыг шууд хольсон тул хурдан түр зуурын бөөмжилт холилдсоны дараа шууд дуусах ёстой байсан бөгөөд Оствальд аажмаар боловсорч гүйцсэн ба/эсвэл үүссэн цөмүүдийн нэгдэх хурдыг хэмжсэн байж болно. Энэ нь n-ийн үндэслэлгүй бага утга, хэт өндөр ханасан байдлын шалтгаан болсон бололтой. Тиймээс, битүү системд хагас суурин бөөмжилтийг бий болгохын тулд тэдгээрийн хэрэглээний хариуд тэдгээрийг ялгаруулдаг мономер зүйлийн зарим усан сан үргэлж шаардлагатай байдаг гэдгийг бид дахин тэмдэглэх ёстой. Бэхер-Дорингийн онолыг оруулаад бөөмийн бүх сонгодог онолууд ийм нөхцөлийг далд байдлаар хүлээж авдаг. Кондуктометрийн тодорхойлолтшинжилгээний аргыг дээрх нийтлэлийн хэсэгт өгсөн.
Бусад эрдэмтэд метилен галид ба мөнгөний ион агуулсан усны импульсийн радиолизээр мөнгөн галидын түр зуурын цөм болох үйл явцыг судалсан бөгөөд энэ явцад метилен галид задрахад импульсийн цацрагаар үүсгэгдсэн гидрат электронууд галидын ионуудыг ялгаруулдаг. 4 нс-ээс 3 мкс хүртэл. Бүтээгдэхүүний спектрийг фото үржүүлэгч болон судалтай камер ашиглан бүртгэж авсан ба мономер мөнгөн галидын урьдал бодисууд хэсэг хугацааны дараа микросекундын дарааллаар үүсч, дараа нь Танака, Ивасаки нарын ажигласантай ижил цөм үүсэх процесс явагддаг болохыг тогтоожээ. Тэдний үр дүнгээс харахад реактив бодисыг шууд холих замаар мөнгөний галогенийг бөөмжүүлэх үйл явц нь хоёр үндсэн үе шатаас бүрддэг; өөрөөр хэлбэл, μs эрэмбийн мономерийн прекурсор үүсэх ба дараа нь 10 мс дарааллын цөмд шилжих явдал юм. Цөмийн дундаж хэмжээ 10 нм орчим байдаг гэдгийг анхаарах хэрэгтэй.
Ханалт
Хур тунадасны туршид желатины уусмалд AgNO3, KCl зэрэг өндөр концентрацитай урвалд ордог нээлттэй систем дэх AgCl тоосонцорын бөөмжилтийн хэт ханалтын коэффициентийн тухайд Strong болон Wey31 1.029 (80°C) - 1.260 (40°C) болон Leubner32 60°C-д AgCl үрийн хэсгүүдийн өсөлтийн хурдыг эгзэгтэй хэт ханасан үед хэмжсэнээр 1.024 гэж мэдээлсэн. Энэ бол тоон шинжилгээний кондуктометрийн аргын мөн чанар юм.
Нөгөө талаас, нээлттэй AgBr бөөмийн системийн хувьд заримKBr-д AgNO3 уусмал нэмэхэд өөр өөр хурдаар ренуклеацийн босгыг олох замаар тодорхойлсон хэмжээнээс хамаарах хамгийн их өсөлтийн хурдаас Wey ба Strong33-ын дагуу 70 ° C-ийн эгзэгтэй хэт ханасан коэффициентийн тооцоолсон утгууд, Scrit: Scrit∼- 1.5 байна. давхар тийрэлтэт үрийн хэсгүүдийн дэргэд уусмал; Хоёр тийрэлтэт AgBr хур тунадасны бөөмжилтийн үе шатанд электрон микроскопоор ажиглагдсан бөөмийн хамгийн бага дундаж хэмжээний талаарх өгөгдлийн хамт Гиббс-Томсоны тэгшитгэлээр тодорхойлогдсон хамгийн их хэт ханасан хүчин зүйл болох Жаганнатан ба Вей34-ийн дагуу 25°С-т скрит=1.2-1.5.. Энэ нь кондуктометрийн хэмжилтийн аргыг хэрэглэхэд маш үр дүнтэй байдаг.

Эдгээр Скритын утгыг тооцоолохдоо γ=140 мЖ m − 2-ыг авсан. Нээлттэй систем дэх бөөмжилт нь урвалд орох бодисын гаралтын ойролцоо хэт өндөр ханасан орон нутгийн бүсэд үүссэн шинээр үүссэн цөмүүдийн оршин тогтнох үйл явцтай тохирч байгаа тул чухал ач холбогдолтой. Хэрэв бид нээлттэй систем дэх (.3 8.3 нм) AgBr цөмийн хамгийн их радиусын тухай Sugimoto35-ын өгөгдлийг куб AgBr (=109 мЖ м −2) онолын γ-тэй ашиглах юм бол хэт ханасан байдал нь хамгийн их хэмжээтэй цөмтэй тэнцвэрт дэх ууссан бодисын концентрацтай тохирч байна.) 3, тэгвэл эгзэгтэй хэт ханасан хүчин зүйл болох Скрит нь 25°С-т 1.36 байхаар тооцогдоно (хэрэв γ-ийг 140 мЖ/м2 гэж үзвэл Скрит=1.48).
Тиймээс ямар ч тохиолдолд эгзэгтэй хэт ханасанМөнгөний галидын бөөмсийн нээлттэй системүүд нь хаалттай систем дэх хамгийн дээд хэт ханалтаас хамаагүй доогуур байдаг (магадгүй чухал хэт ханасантай ойролцоо). Учир нь задгай системийн орон нутгийн бүсэд үүссэн цөмийн дундаж радиус нь хаалттай системд rm -аас хамаагүй их байдаг нь ил задгай системийн орон нутгийн бүсэд өндөр төвлөрсөн анхдагч цөмүүдийн агшин зуурын нэгдлээс үүдэлтэй байж магадгүй юм. орон нутгийн электролитийн концентраци.
Програм
Ферментийн процессын явцад тасралтгүй бичлэг хийх кондуктометрийн титрлэлтийн аргыг өргөнөөр судалж, дүн шинжилгээ хийсэн. Бараг бүх цахилгаан химийн аналитик аргууд нь цахилгаан химийн урвал (потенциометр, вольтметри, амперометр, кулометр) дээр суурилдаг.
Кондуктометрийн шинжилгээний арга нь электродууд дээр цахилгаан химийн урвал огт байхгүй, эсвэл үл тоомсорлож болох хоёрдогч урвал байдаг арга юм. Иймээс энэ аргын хувьд хилийн давхарга дахь электролитийн уусмалын хамгийн чухал шинж чанар нь биологийн урвалын нэлээд өргөн хүрээний дагуу өөрчлөгддөг цахилгаан дамжуулах чанар юм.
Ашиг тус
Кондуктометрийн био мэдрэгч нь бусад төрлийн хувиргагчаас зарим давуу талтай. Нэгдүгээрт, тэдгээрийг хямд өртөгтэй нимгэн хальсан стандарт технологи ашиглан хийж болно. Энэ нь биологийн материалыг хөдөлгөөнгүй болгох оновчтой аргыг ашиглахын зэрэгцээ төхөөрөмжийн үндсэн өртөг болоншинжилгээний нийт зардал. Суурилуулсан микробиосенсорын хувьд дифференциал хэмжилтийн горимыг гүйцэтгэхэд хялбар бөгөөд энэ нь гадны нөлөөллийг нөхөж, хэмжилтийн нарийвчлалыг ихээхэн сайжруулдаг.
Өгөгдөл нь кондуктометрийн био мэдрэгчийн асар их боломжийг тодорхой харуулж байна. Гэсэн хэдий ч энэ нь биосенсорын нэлээн шинэ чиг хандлага хэвээр байгаа тул арилжааны төхөөрөмж хөгжүүлэх ирээдүйтэй ирээдүйтэй.
Шинэ аргууд
Зарим эрдэмтэд pKa-г дамжуулах чадвараар хэмжих ерөнхий аргыг тодорхойлсон. Энэ аргыг ойролцоогоор 1932 он хүртэл өргөн хэрэглэж байсан (рН хэмжих аргыг хэрэглэхээс өмнө). Кондуктометрийн арга нь температурт маш мэдрэмтгий тул давхцаж буй pKa утгыг хэмжихэд ашиглах боломжгүй. Хромофоргүй дээжийн боломжит давуу тал нь үүнийг 2.8х10-5 М хүртэл маш шингэрүүлсэн уусмалд ашиглах боломжтой байдаг. Сүүлийн жилүүдэд кондуктометр 87-г лидокаины pKa-г хэмжихэд ашигласан боловч үр дүн нь 0.7 байсан. нийтээр хүлээн зөвшөөрөгдсөн рН-ийн утгаас доогуур нэгж тутамд.

Альберт, Түрүүч нар уусах чадварын хэмжилтээс pKa тодорхойлох аргыг мөн тодорхойлсон. Дээр дурьдсанчлан уусах чадвар нь pKa-аас хамаардаг тул уусах чадварыг муруй дээрх олон рН утгуудаар хэмжвэл pKa-г тодорхойлж болно. Пек, Бенет нар уусах чадвар, рН-ийн хэмжилтийн багцыг харгалзан монопротик, дипротик, амфотер бодисуудын pKa утгыг тооцоолох ерөнхий аргыг тодорхойлсон. Хансен, Хафлигер нар дээжийн pKa-г олж авсанэргэдэг дискний төхөөрөмж дэх рН-ийн функцээр анхны уусах хурдаасаа гидролизийн явцад хурдан задардаг. Үр дүн нь рН / хэт ягаан туяаны үр дүнтэй тохирч байгаа боловч задрал нь сүүлчийн аргыг хэцүү болгодог. Энэ нь ерөнхийдөө кондуктометрийн шинжилгээний аргын тайлбар юм.






